Se está procurando uma maneira divertida e interativa para ensinar reações de equilíbrio químico, este é um ótimo experimento para fazer com seus alunos! O vai e vem das cores mostra, de maneira prática, conceitos básicos das reações ácido-base em equilíbrio químico em uma versão criativa e didática. E o experimento usa materiais bem simples e fáceis de manipular, para que tanto os professores quanto os alunos possam colocar a mão na massa, eles são o leite de magnésia (Mg(OH)2), ácido clorídrico (HCl) e indicador universal. Esta é uma demonstração colorida, que permite investigar os equilíbrios ácido-base e de solubilidade. Veja como ele funciona abaixo.
Preparando o experimento
Você vai precisar de 3 reagentes:
- uma suspensão de hidróxido de magnésio, conhecida como leite de magnésia (encontrada em farmácias);
- ácido clorídrico 1 mol/L;
- indicador universal (ou um extrato de repolho roxo).
Vai precisar também de um béquer ou frasco transparente de 1 L. Finalmente, você vai precisar de uma maneira de agitar a solução. Isso pode ser feito manualmente com um bastão de vidro, mas usaremos um agitador magnético para um efeito visualmente mais interssante.
No experimento usamos o hidróxido de magnésio, Mg(OH)2, que é vendido nas farmácias na forma de uma suspensão, com o nome de leite de magnésia. O leite de magnésia é um antiácido, ou seja, é usado para combater o excesso de ácido no estômago.
Para começar a demonstração coloque duas colheres de chá de leite de magnésia em um béquer com 800 ml de água em um agitador magnético com uma barra magnética dentro. Em seguida, adicione 3 ml do indicador universal com uma pipeta de Pasteur, assim será possível observar a mudança do pH pela coloração da solução.
A demonstração está pronta para iniciar.

Apresentando a demonstração
Chame a atenção dos alunos para o béquer no agitador. Mostre que a cor da solução, inicialmente está roxa. O indicador universal é uma mistura de indicadores ácido-base, sendo que cada um deles muda de cor em uma faixa distinta.
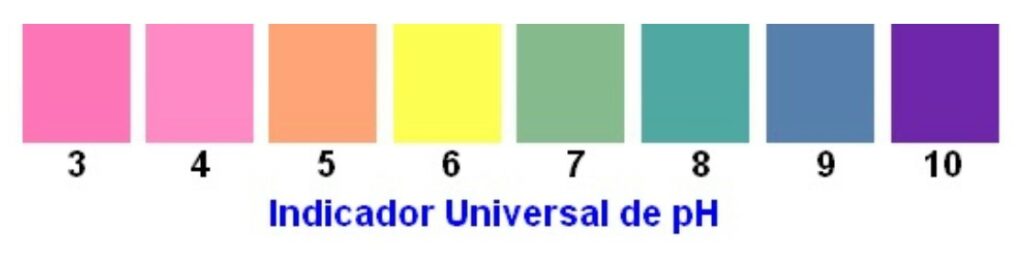
A cor roxa indica que a solução está alcalina, com pH acima de 10. Isso é devido à presença do hidróxido de magnésio, que apesar de pouco solúvel, ainda sim possui íons dispersos que conseguem reagir com o indicador e expressar sua cor em meio alcalino.
Para dar início a reação adicione o ácido clorídrico de 1 em 1 ml no béquer. Se decidir fazer esta demonstração seria interessante pedir atenção e explicar o que irá acontecer na reação neste momento, para facilitar na hora dos alunos colocarem a mão na massa. Após o fim da reação, que é vista quando a cor do líquido volta a cor inicial (roxa), repita o procedimento mais algumas vezes e depois divida a sala em grupos e os instrua a como fazer o mesmo com os tubos de ensaio.
Para realizar o experimento com o tubo de ensaio é preciso adicionar água no tubo até a metade, uma colher de chá do antiácido, 5 gotas do indicador e algumas gotas de ácido, é preciso gotejar até observar uma mudança de cor, depois eles devem chacoalhar uma vez para homogeneizar, apoiar o tubo em um suporte e observar a reação. Peça para que repitam algumas vezes o processo de adicionar o ácido até neutralizar toda a reação.
Como dica de estudo de apoio pode fazer um questionário para o grupo responder com perguntas em relação a estequiometria da reação, o que a mudança de cores indica e a importância do ph neste tipo de experimento.
O que acontece
Este experimento é um exemplo de uma reação de neutralização ácido-base. Nele usa-se o leite de magnésia, que é simplesmente o hidróxido de magnésio, Mg(OH)2, uma base forte e pouco solúvel.
Quando adicionamos o hidróxido de magnésio à agua no início da demonstração, uma pequena parte dele consegue se dissolver, enquanto a maior parte continua sólido, em suspensão. Rapidamente um equilíbrio é estabelecido, em que a quantidade de íons hidróxido é suficiente para elevar o pH e tornar o indicador universal roxo.
Podemos representar esse equilíbrio com a equação abaixo:

Ao adicionarmos o ácido clorídrico, ele rapidamente neutraliza os íons hidróxido em solução, formando água.
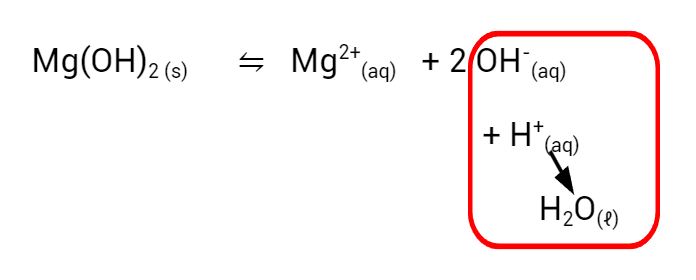
O excesso de ácido clorídrico, comparado com o hidróxido em solução, faz com que a solução se torne ácida, e o indicador universal fica vermelho. É interessante relacionarmos o ácido clorídrico usado no experimento que é o mesmo ácido presente no nosso estômago.
Mas ainda temos muito hidróxido de magnésio no béquer. Aos poucos, o hidróxido de magnésio se dissolve, repondo os íons hidróxido em solução. Nós podemos perceber isso ao acompanharmos as cores do indicador universal, que passa por todas as suas cores até chegar novamente na cor roxa de uma solução alcalina.
Um dos conceitos importantes que esta demonstração traz é como um equilíbrio pode ser perturbado (pela adição do ácido) e como podemos prever o efeito dessa perturbação a partir do princípio de Le Chatelier. Quando a concentração de íons hidróxido diminui, a resposta do sistema é deslocar o equilíbrio para a direita, repondo esses íons. Ao repetir a demonstração diversas vezes, podemos chamar a atenção dos alunos e discutir o que está acontecendo em cada momento.
Finalmentes
Você gostou do experimento? Pensa em usá-lo nas suas aulas? O Xciência possui o kit para empréstimo, para professores de Química. Com este experimento você demonstrar o deslocamento de um equilíbrio de solubilidade e o que acontece com o equilíbrio ácido-base associado.
Comente abaixo e compartilhe com seus colegas.


1 comentário
[…] Vai e vem das cores […]