Existem muitos experimentos e demonstrações que tratam da densidade. A densidade é uma das propriedades das substâncias que podemos observar e medir com uma certa facilidade e que pode ter resultados intrigantes e inesperados. Nesta demonstração podemos observar o que acontece ao se colocar o gás carbônico sobre velas acesas, e discutir as densidades relativas de diferentes gases.
Preparando a demonstração
- velas
- bicarbonato de sódio
- vinagre
- béquer de 1 L ou garrafa PET de 2L com o bico cortado
- suporte para as velas (fizemos o nosso com o corte a laser)

Coloque as velas no suporte, espaçadas ao longo da rampa. Você pode prender as velas derretendo a parafina na sua base.
Separe o bicarbonato de sódio (cerca de meia colher de sopa, a quantidade exata não é importante) em um béquer pequeno ou copo de café plástico. Separe também cerca de 35 mL de vinagre em outro béquer ou copo de café.
Nós usamos um isqueiro e um palito de madeira para acender as velas.
A demonstração está pronta para ser apresentada.

Fazendo a demonstração
Retire uma das partes de acrílico do suporte e acenda as velas. Adicione o bicarbonato de sódio na garrafa de PET cortada (ou em um béquer de 1 litro de forma alta). Chame a atenção dos alunos para a garrafa, mostrando o bicarbonato de sódio. Adicione na garrafa o vinagre, tampando a boca da garrafa e mostrando a efervescência aos alunos. Após alguns segundos, quando a liberação de gás estiver encerrada, aproxime a garrafa do alto da rampa. Entorne o gás na rampa e observe o que ocorre com as velas.
O que acontece
Na primeira parte do experimento, adicionamos vinagre ao bicarbonato de sódio. O vinagre é uma solução diluída de ácido acético. Uma reação química ocorre, formando gás carbônico e acetato de sódio. Essa reação pode ser representada pela equação abaixo:
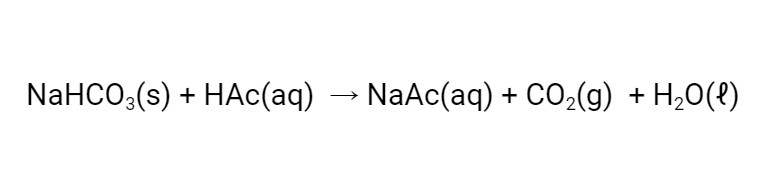
O gás carbônico é mais denso que o ar. A densidade de um gás depende diretamente da massa molar das suas moléculas. No ar, temos principalmente o gás nitrogênio (N2, massa molar 28g/mol) e oxigênio (O2, massa molar 32 g/mol). A densidade do ar, assim, vai ser bem menor que a do dióxido de carbono, o CO2 – este tem uma massa molar de 44 g/mol.
A densidade do gás carbônico é 1,8 gramas por litro, a 25 oC e 1 atmosfera. Já a densidade do ar é cerca de 1,2 gramas por litro (a a 15 oC e 1 atmosfera).
Quando o gás carbônico produzido na garrafa PET é colocado sobre as velas acesas, ele desloca todo o ar (e portanto, todo o oxigênio) ao redor das velas. Isso faz com que as velas não consigam mais continuar a combustão, uma vez que não há mais oxigênio ao redor da vela. Esse é o princípio usado nos extintores de incêndio de gás carbônico.
Finalmentes
Este experimento pode ser feito de maneira bem mais simples, usando apenas uma vela, mas sem dúvida ver as velas apagando uma atrás da outra causa um efeito muito mais impressionante.
Professores de Belo Horizonte e região podem pegar este material emprestado no XCiência. Gostou do expeirmento? Conte pra gente num comentário abaixo e compartilhe o artigo com seus colegas.

