Não é à toa que damos tanta importância para a água. Além de cobrir a maior parte do nosso planeta e constituir a maior parte do nosso corpo, a água é algo essencial para nossa vida. Precisamos de água potável para nosso consumo e de água em diversos graus de pureza para outras atividades como limpeza, em atividades industriais e na agricultura.
É muito comum se falar sobre os processos de purificação da água em aulas de ciências. Que tal então demonstrar para seus alunos uma das etapas da purificação e discutir um tanto de Química junto com isso? É o que vamos mostrar neste artigo no XCiência.
Preparando a demonstração
- água
- terra
- solução de sulfato de alumínio 0,1 mol/L
- solução de carbonato de sódio 0,1 mol/L
- tubo de ensaio e suporte (ou pré-forma)

Coloque o tubo de ensaio ou pré-forma de PET no suporte. Adicione água da torneira até cerca de três quartos da altura do tubo.
Adicione uma pequena quantidade de terra ao tubo e agite bem. Tipos diferentes de solo irão fornecer resultados diferentes. A ideia é encontrar um tipo de terra que apresente partículas bem pequenas, que irão ficar em suspensão e não irão se depositar rapidamente no fundo do tubo.
A demonstração está pronta para ser apresentada.
Fazendo a demonstração
Mostre para os alunos o tubo contendo as partículas de terra em suspensão. Chame a atenção para o fato de que esse material não é solúvel em água e que, pela pequena dimensão de suas partículas, ele permanece em suspensão por muito tempo. As partículas coloidais (ou seja, com tamanho menor do que xxx micrômetros) não irão afundar na água, mesmo sendo mais densas, devido à agitação das moléculas de água.
É importante remover esse material em suspensão na água, pois é nele que se concentram bactérias e vírus. Assim, remover esse material é mais do que apenas tornar a água límpida e mais agradável visualmente, é algo fundamental para se tornar a água potável.
Mostre para os alunos que o material em suspensão não está afundando. Acrescente a solução de sulfato de alumíno (cerca de 10 gotas). Agite a solução. Em seguida, acrescente a solução de carbonato de sódio (cerca de 30 gotas) e agite por 15 a 30 segundos.
Coloque o tubo de volta no suporte e peça para os alunos observarem o que acontece nos próximos minutos. O vídeo abaixo mostra o que acontece no experimento.
O que acontece
Quando acrescentamos o carbonato de sódio na água, formamos uma solução alcalina (básica). Isso acontece porque o ânion carbonato forma os íons hidróxido em solução aquosa devido ao equilíbrio que pode ser representada pela equação abaixo:
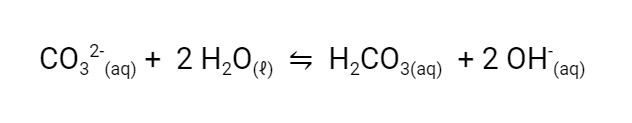
Este equilibrio fica deslocado para a direita porque o ácido carbônico é um ácido fraco. Chamamos este tipo de equilíbrio de equilíbrio de hidrólise do íon carbonato.
Quando adicionamos o sulfato de alumínio, ocorre uma reação química com os íons hidróxido, formando um composto insolúvel, o hidróxido de alumínio.
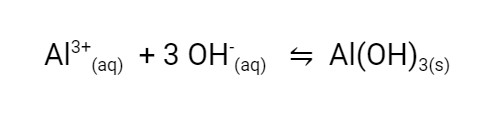
O hidróxido de alumínio vai formar partículas insolúveis que vão se juntar às partículas em suspensão da terra, formando partículas maiores e mais densas, que vão decantar mais facilmente no fundo do recipiente.
Nas estações de tratamento de água, uma das etapas do tratamento é a decantação do material em suspensão e, em muitos casos, a reação entre um sal de alumínio e uma solução básica é usada para favorecer a floculação e a decantação desse material.
O kit Qui+S
O Xciência participou da elaboração de um kit com os materiais para a realização deste experimento, em parceria com o Qui+S, uma iniciativa da Sociedade Brasileira de Química (SBQ) e do INCT MIDAS, com o apoio do Conselho Federal de Química (CFQ). Os kits estão sendo distribuídos para professores de Química gratuitamente em eventos.

Finalmentes
Gostou do experimento? Tem alguma sugestão? Usou na sua aula? Conte pra gente nos comentários abaixo. E não esqueça de compartilhar com seus colegas.

