Construir modelos de moléculas pode ser uma atividade muito rica, especialmente quando os alunos podem fazer esta atividade passo a passo, pensando como os átomos e moléculas devem se organizar.
Neste artigo vamos sugerir uma atividade em que os alunos constroem um modelo das interações moleculares entre moléculas de água. Para isso, vamos usar um modelo que já mostramos aqui no Xciência, o Modelo Molecular com corte a laser.
Preparando o experimento
Você vai precisar de (para cada grupo de alunos):
1 kit de modelos moleculares contendo:
5 átomos de oxigênio;
6 átomos de hidrogênio;
4 átomos de hidrogênio que façam duas conexões;
4 conectores mais longos para ligação de hidrogênio;
6 conectores curtos para ligação O-H.

A atividade
Inicialmente, ajude os alunos a identificarem as peças do modelo molecular. Mostre para eles que o átomo de oxigênio é representado pela peça com a cor vermelha e o átomo de hidrogênio pelas peças de cor branca. Você pode pedir para os alunos registrarem as etapas da atividade usando fotos que podem ser enviadas ao professor.
O primeiro passo é montar uma molécula de água, H2O:

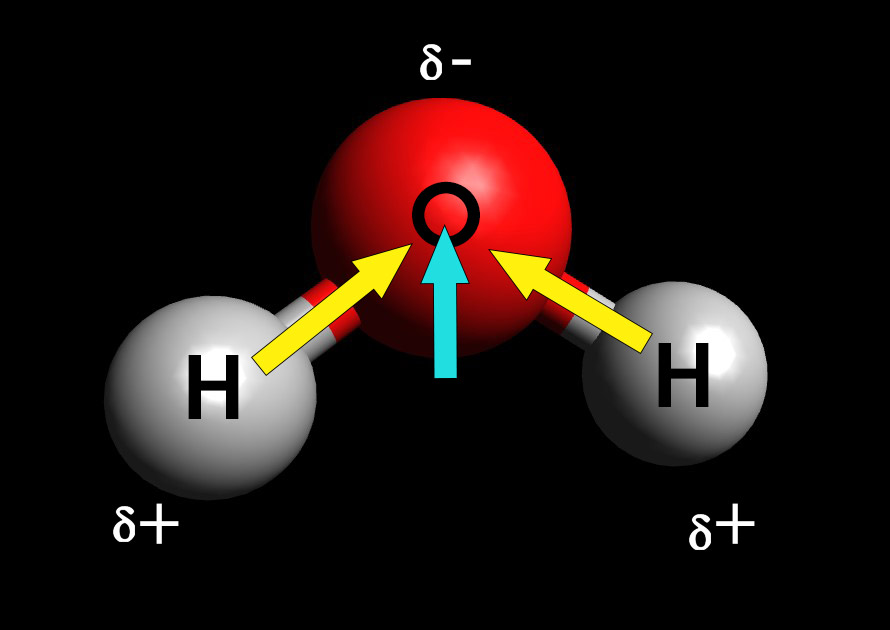
Para isso, devemos pegar dois átomos de hidrogênio (peças brancas com apenas uma conexão) e conectá-los ao átomo de oxigênio usando os canudos pretos. Chame a atenção dos alunos para o fato de que a molécula de água possui uma geometria angular. Como o átomo de oxigênio é mais eletronegativo que o hidrogênio, ou seja, como ele tem uma maior tendência de atrair os elétrons, as ligações O-H são ligações polares.
Como a molécula de água não é linear, possui um ângulo diferente de 180 graus entre os hidrogênios, o resultado da soma vetorial dos momentos de dipolo é diferente de zero: a água é uma molécula polar.
Peça aos alunos para construírem uma segunda molécula de água. Em seguida peça para eles manipularem os modelos e posicionarem as moléculas de água uma próxima da outra. Considerando a polaridade das moléculas de água, como elas devem se posicionar? Após discutir com os alunos que o lado mais positivo da molécula de água deve apontar para o lado mais negativo da molécula de água vizinha, oriente-os para substituir o hidrogênio por uma peça branca com duas conexões. Conecte as duas moléculas de água com um canudo branco, mais longo.
Essa conexão entre as moléculas representa uma ligação de hidrogênio, uma interação molecular do tipo dipolo-dipolo que recebe este nome especial.


Será que é possível uma molécula de água fazer mais de uma ligaçaõ de hidrogênio com moléculas vizinhas? Podemos construir mais moléculas de água para investigar isso.
Podemos conectar mais uma molécula de água ao átomo de oxigênio da molécula de água central, da mesma forma que fizemos anteriormente.



Podemos conectar mais moléculas de água na molécula de água central? Peça aos alunos para construírem mais moléculas de água e tentarem posicioná-las próxima da molécula de água central.


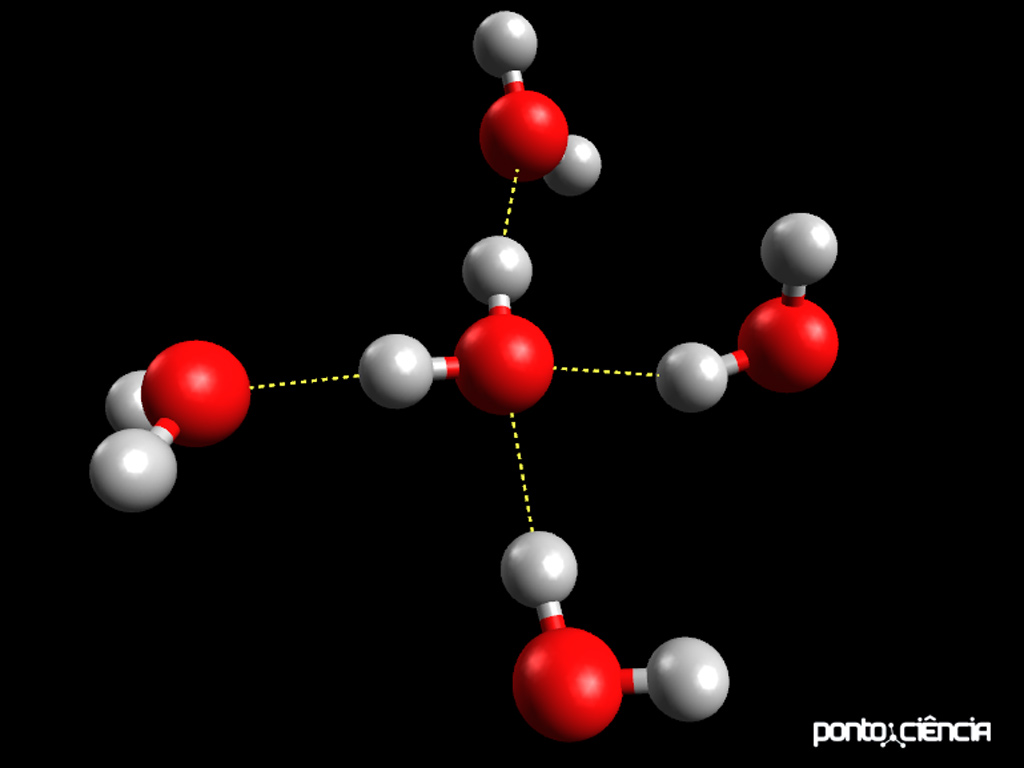
Chame a atenção dos alunos para o fato de que a molécula central está fazendo quatro ligações de hidrogênio com moléculas vizinhas. Em cada caso, o átomo de hidrogênio de uma molécula está apontando para o átomo de oxigênio de outra molécula, o lado mais positivo da molécula de água está voltado para o lado mais negativo de outra.
A Atividade
Abaixo colocamos uma sugestão de atividade para você usar com os seus alunos. Caso não consiga ver o arquivo, faça o download aqui: http://www.xciencia.org/wp-content/uploads/2024/05/Modele-as-ligacoes-de-hidrogenio-da-agua.pdf.
Kit QUI+S

O XCiência participou da elaboração de um kit com os materiais para esta atividade, que está sendo distribuído para professores de Química como parte da divulgação do programa Qui+S e do seu curso online Química e Sustentabilidade na Escola. Se você ainda não conhece, visite https://quimaiss.com.br/ e se matricule no curso, é 100% gratuito. Um dos capítulos do curso lida com a questão da água e sustentabilidade. Esta atividade pode ser usada em conjunto com uma discussão das questões ambientais da água.
O que acontece
É interessante perceber que a água consegue fazer até quatro ligações de hidrogênio com moléculas de água vizinhas. Na água líquida, essas interações estão sendo formadas e quebradas o tempo todo, à medida que as moléculas se movimentam.
Caso você discuta com seus alunos a geometria da água usando a teoria VSEPR (aquela da repulsão dos pares de elétrons ao redor de um átomo central), vocês vão reparar que o átomo de oxigênio tem dois pares de elétrons livres. Assim, os dois pares de elétrons das ligações O-H na água e os dois pares de elétrons livres somam quatro pares – o que faz com que esses pares assumam uma geometria tetraédrica. Por isso o nosso átomo de oxigênio no modelo é um tetraedro.
Podemos atribuir à intensidade e ao número dessas interações diversos comportamentos diferenciados da água. Por exemplo, para uma molécula tão pequena e tão leve, a água apresenta uma temperatura de ebulição muito maior do que o esperado, quando comparada com outras moléculas de tamanho similar. A alta tensão superficial da água também é um resultado das fortes interações entre moléculas de água. Quando a água se solidifica, essas ligações seguem estes ângulos e o resultado é que as moléculas de água ficam em média mais afastadas do que na água líquida. Isso faz com que a densidade do gelo seja menor que a da água líquida.
Na imagem abaixo podemos ver uma representação das ligações de hidrogênio entre moléculas de água, similar à que fizemos com os modelos moleculares.
Finalmentes
Gostou da atividade? Entender as interações moleculares na molécula de água ajuda a entender as suas propriedades. Você trabalha este tema com seus alunos? Comente aqui em baixo e compartilhe o artigo com seus colegas.
