Estudar sobre o equilíbrio químico não é uma tarefa fácil, e os alunos apresentam diversas dificuldades para entender os conceitos associados a esse conteúdo.
O uso da experimentação pode contribuir para ampliar o entendimento dos estudantes, especialmente quando acompanhado de uma ampla discussão sobre o que foi observado.
No artigo de hoje, vamos descrever um experimento que pode ser usado ao se apresentar o equilíbrio ácido-base. Ele mostra o que acontece com o equilíbrio de dissociação do ácido acético quando se adiciona íons acetato.
Preparando o experimento
- solução de ácido acético 2 mol/L
- solução de acetato de sódio 2 mol/L
- solução de ácido clorídrico 2 mol/L
- carbonato de cálcio sólido
- solução de indicador universal
- pasta L de plástico transparente
- folha impressa com instruções para os alunos
- conta-gotas
Realizando o experimento
Coloque as soluções em frascos conta-gotas, para facilitar o seu uso. Coloque a folha impressa dentro da pasta L.
Adicione 2 gotas da solução de indicador universal em cada um dos círculos, diretamente sobre o plástico.
No primeiro círculo, coloque 3 gotas de ácido acético.
No segundo círculo, coloque 3 gotas de solução de ácido acético e três gotas de solução de acetato de sódio.
Já no terceiro círculo, coloque 3 gotas da solução de ácido clorídrico. Observe as cores do indicador universal em cada círculo.
Adicione uma ponta de espátulo de carbonato de cálcio em cada um dos círculos. Observe e compare a reação em cada círculo.
O que acontece
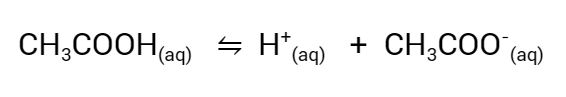
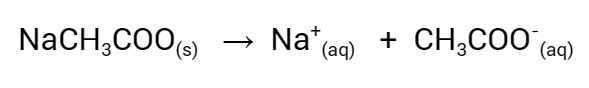
O acetato de sódio causa um deslocamento do equilíbrio químico da ionização do ácido acético para a esquerda, promovendo a formação de ácido acético não ionizado. Como resultado, a quantidade de íons H+ diminui na solução, tornando-a menos ácida e aumentando o pH.
Segundo o princípio de Le Chatelier, quando um componente de um sistema em equilíbrio é adicionado, o sistema se ajusta para reduzir o efeito dessa adição. Neste caso, a adição de CH3COO− faz com que o equilíbrio da dissociação do ácido acético se desloque para a esquerda, promovendo a formação de ácido acético não ionizado. Em decorrência disto a quantidade de íons H+ diminui na solução, pois parte do ácido acético se converte em sua forma não ionizada e o pH da solução aumenta, tornando-a menos ácida.
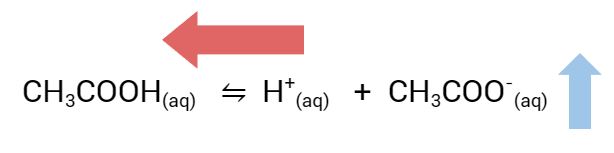
Nós usamos a reação com carbonato de cálcio para indicar a acidez relativa das três soluções. Ao reagirmos o carbonato de cálcio com um ácido, observamos a liberação de gás carbônico.
Podemos ver que a reação com o ácido forte, o ácido clorídrico, é a mais intensa. Em seguida, temos a reação com o ácido acético na mesma concentração, que é visivelmente menos intensa. Por fim, a solução de ácido acético com acetato de sódio é a mais lenta, mostrando que esta é a menos ácida de todas.
Finalmentes
Gostou do experimento? Compartilhe e mostre para seus colegas.
Procurando mais experimentos sobre equilíbrio químico? Temos vários:

